- Месторождения медных руд
- 2 Природные соединения, в составе которых имеется медь
- ПРИМЕНЕНИЕ
- ЗАПАСЫ И ДОБЫЧА
- 3 Редкие вторичные минералы меди – краткий обзор
- Способы добычи минерала
- ПРОИСХОЖДЕНИЕ
- Разновидности медных руд
- Природные соединения с содержанием меди в своем составе
- Технологии производства меди
- Природные соединения с содержанием меди
- КЛАССИФИКАЦИЯ
- Альтернативный способ обогащения меди
- ФИЗИЧЕСКИЕ СВОЙСТВА
- Из каких руд получают медь
- Халькозин
- Халькопирит
- Борнит
- Медь. Химия меди и ее соединений
- Электронное строение меди
- Физические свойства
- Нахождение в природе
- Способы получения меди
- Качественные реакции на ионы меди (II)
- Химические свойства меди
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Соли меди
- Соли меди (I)
- Минеральная база для извлечения металла
- ОПТИЧЕСКИЕ СВОЙСТВА
Месторождения медных руд
Медные руды — это скопления минералов, которые, помимо меди, содержат другие элементы, определяющие их свойства, в частности никель. К категории меди относятся те виды минералов, в которых этот металл содержится в таком количестве, что было бы экономически целесообразно извлекать его промышленными методами. Этим условиям соответствуют минералы, содержание меди в которых составляет от 0,5 до 1%. На нашей планете есть запасы медьсодержащих ресурсов, большая часть которых (90%) — медно-никелевые руды.
Большая часть запасов медных руд в России находится в Восточной Сибири, на Кольском полуострове, в Уральском регионе. Чили входит в список лидеров по суммарным запасам этих полезных ископаемых; месторождения также разрабатываются в следующих странах: США (порфировые минералы), Казахстан, Замбия, Польша, Канада, Армения, Заир, Перу (порфировые минералы), Конго, Узбекистан. Эксперты подсчитали, что общие месторождения меди во всех странах составляют около 680 миллионов тонн. Конечно, вопрос о том, как добывают медь в разных странах, нужно рассматривать отдельно.

Ковеллин
Все месторождения медных руд делятся на несколько категорий, различающихся по генетическим и промышленно-геологическим характеристикам:
- стратиформная группа, представленная медными сланцами и песчаниками;
- колчеданные руды, в состав которых входят самородная и жильная медь;
- гидротермальный, включая минералы, называемые медным порфиром;
- магматические, которые представлены наиболее распространенными медно-никелевыми минералами;
- минералы скарнового типа;
- карбонатные, представленные железо-медными и карбонатитовыми рудами.
В России медь в основном добывается в сланцевых и песчаных месторождениях, в которых минерал содержится в пиритовых формах меди, медно-никелевых и медно-порфировых.

Борнит
2 Природные соединения, в составе которых имеется медь
В природе медь в самородном виде встречается редко. Очень часто он «прячется» в различных соединениях. Наиболее известные из них:
- Борнит — минерал, названный в честь ученого из Чехии И. Борна, химическая формула которого — Cu5FeS4; Часто можно услышать старые названия соединения: пурпурная медь, пестрый медный колчедан. Этот минерал может иметь две полиморфные модификации: тетрагонально-скаленоэдрическую (температура не выше 228) и кубико-гексаоктаэдрическую (температура выше 228 ° С). Медный фиолетовый также отличается по своему происхождению, он экзо- и эндогенный. Первый часто развивается как ранний вторичный сульфид, который легко разрушается атмосферными агентами. А в эндогенном пестроцветном пирите часто присутствуют галенит, халькоцит, пирит, сфалерит и халькопирит. Из-за этого химический состав минерала нестабилен (теоретические показатели с 25,5% серы, 11,2% железа и 63,3% меди в природе практически не выдерживаются).

- Халькопирит (формула — CuFeS2): минерал, ранее называвшийся медным пиритом, имеет гидротермальное происхождение и входит в полиметаллические минералы (вместе со сфалеритом и галенитом). Встречается в скарнах (метасоматитовая порода контактного типа) и грейзенах (метасоматитовая порода), образующихся в данном случае в результате метаморфических процессов.

- Халькоцит (сульфид меди с формулой Cu2S): содержит 20,2% серы и 79,8% меди. Из-за ярко выраженного металлического блеска его часто называют «медным блеском». Для него характерны различные оттенки (от свинцово-серого до абсолютно черного). В природе халькоциты встречаются в виде густых или зернистых выделений.
ПРИМЕНЕНИЕ

Медные браслеты
Из-за низкого удельного сопротивления медь широко используется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, в печатной проводке. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Еще одно полезное качество меди — высокая теплопроводность. Это позволяет использовать его в различных устройствах отвода тепла, теплообменниках, в том числе в хорошо известных радиаторах для охлаждения, кондиционирования и отопления.
Медные сплавы широко используются в различных областях техники, наиболее распространенными из которых являются упомянутые выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, которые, помимо олова и цинка, могут включать никель, висмут и другие металлы.
В ювелирном деле медно-золотые сплавы часто используются для повышения устойчивости изделий к деформации и истиранию, поскольку чистое золото — очень мягкий металл и не устойчиво к этим механическим воздействиям.
Ожидаемым новым массовым использованием меди обещает стать ее использование в качестве бактерицидных поверхностей в больницах для уменьшения передачи внутрибольничных бактерий: двери, ручки, водяные клапаны, перила, поручни кроватей, столешницы — все поверхности, к которым прикасается рука человека.
Медь — Cu
| Молекулярный вес | 63,55 г / моль |
| Происхождение названия | От греческого «Киприум», что означает «кипрский металл», от названия острова Кипр |
| Статус IMA | действителен, впервые описан до 1959 г. (до IMA) |
ЗАПАСЫ И ДОБЫЧА

Медный образец, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) составляет (4,7-5,5) 10-3% (по массе). В морской и речной воде содержание меди значительно ниже: 3 · 10-7% и 10-7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде колеблется от 0,3 до 1,0%. Мировые запасы в 2000 году составляли, по оценкам экспертов, 954 миллиона тонн, из которых 687 миллионов тонн — доказанные запасы, на долю России приходилось 3,2% общих и 3,1% мировых доказанных запасов. Таким образом, при текущих темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы производства меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных минералов, например халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; медь вытесняется из полученных растворов металлическим железом.
3 Редкие вторичные минералы меди – краткий обзор
Гораздо реже встречаются другие медные руды, среди которых можно выделить следующие:
- Куприт: Cu2O, не образует больших скоплений, встречается вместе с самородной медью и малахитом в землистых и зернистых массах, относится к оксидным минералам, имеет индекс твердости 4 единицы.

- Ковеллин: сульфид меди метасоматического образования, обнаруженный в начале 19 века недалеко от Везувия. Сейчас его добывают в Колорадо (США), Сербии, Италии, Чили. Этот мягкий минерал содержит около 33,5% серы и 66,5% меди.
- Малахит: углекислый медно-зеленый, дигидрококкарбонат меди, образующийся вблизи участков окисления полиметаллических гидротермальных отложений и минералов меди во время гипергенных явлений. Многие медные руды сопровождаются малахитом. В России его месторождения разрабатываются в районе Нижнего Тагила (Меднорудянский рудник, известный специалистам), а ранее руда добывалась на Урале (в настоящее время не ведется).

- Азурит: минерал синего оттенка, названный в честь медно-синего цвета, с твердостью 3,5-4 единиц. Сейчас он в основном добывается в африканских странах (Марокко, Конго, Намибия), а также в Австралии, Англии, Греции и Франции. Чаще всего сливается в единое целое с описанным выше малахитом, встречается в окислительных зонах у поверхности многих месторождений сульфида меди.
Способы добычи минерала
В России есть такие месторождения, как сланцы и песчаники. Здесь встречаются пиритные формы меди, медно-никелевые и медно-порфировые. В горнодобывающей промышленности используются различные методы добычи полезных ископаемых из недр земли.
В зависимости от глубины залегания минерал добывают открытым или закрытым способом. Существуют нормативы, определяющие желательность глубины выемки грунтовых пластов, использование технологий, снижающих их стоимость.

Технология работы включает в себя следующее:
- использование самоходной техники;
- прямое производство добычи руды;
- заполните образовавшиеся пустоты материалами, чтобы сделать работу более безопасной.
При открытом методе окаменелости отбираются слоями, что гарантирует их максимальное использование. Для карьеров большой глубины подходит технология циклических поточных операций, это зависит от характеристик пластов.

Отрицательные эффекты майнинга
При заглублении швов на глубину от 500 до 1000 м и более удобен закрытый метод извлечения меди. Для этого требуются вибрационные механизмы, осуществляется непрерывная выемка породы и доставка ее на поверхность. Пустоты, образовавшиеся в недрах, заполняются; для этого используются трубки, покрытые резиной или базальтовой смолой.
экономически выгодно размещать предприятия по переработке полезных ископаемых в непосредственной близости от мест их добычи. Здесь тоже необходимо построить объекты для захоронения отходов после переработки. Это может помочь высвободить множество полезных продуктов. Например, переработка диоксида серы позволяет получать полезные удобрения с содержанием серы.
ПРОИСХОЖДЕНИЕ

Маленький медный самородок
Самородная медь обычно образуется в зоне окисления некоторых месторождений сульфида меди в сочетании с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Масса отдельных скоплений самородной меди достигает 400 тонн. Крупные промышленные месторождения самородной меди, наряду с другими медьсодержащими минералами, образуются, когда вулканические породы (диабаз, мелафири) подвергаются воздействию гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение Верхнее озеро, США АМЕРИКА).
Самородная медь также содержится в осадочных породах, в основном в медистых песчаниках и сланцах.
Наиболее известные коренные месторождения меди — рудники Турина (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
Разновидности медных руд
Классификация минерала по генетическим и геологическим характеристикам:
- стратиформные: это песчаники и сланцы;
- пирит — медь с прожилками и самородки;
- гидротермальный — медная форма называется порфиром;
- скарновые породы;
- магматический — в этом минерале содержится никель;
- карбонатные — имеют железо-медный и карбонатитовый состав.
Природные соединения с содержанием меди в своем составе
Самородки чистой меди на нашей Земле встречаются в небольших количествах. В основном его добывают в сочетании с другими элементами, вот самые известные:
- Борнит — минерал, названный в честь чешского ученого Борна. Это сульфидный минерал. У него также есть альтернативные названия, такие как медно-фиолетовый. Он извлекается двух типов: тетрагонально-скаленоэдрический при низкой температуре и кубический гексаоктаэдр при высокой температуре. Разница между видами этого материала зависит от того, откуда он возник. Экзогенный борнит — это ранний вторичный сульфид, который нестабилен и подвержен разрушению при воздействии ветра. Эндогенный борнит имеет изменчивый химический состав; в нем могут присутствовать различные элементы, например халькоцит и галенит. Теоретически борнит может содержать 11% железа и более 63% меди, но, к сожалению, на практике этот состав не сохраняется.
- Халькопирит — этот вид минерала изначально назывался медным пиритом, имеет гидротермальное происхождение. Халькопирит относится к полиметаллическим минералам. Помимо меди, такой минерал содержит железо и серу. Он образуется в результате метаморфических процессов и присутствует в метасоматических типах медных руд.
- Чалкозин — такой минерал содержит большое количество меди, почти 80%, остальное место занимает сера. Часто этот вид называют медным блеском по-другому, так как его поверхность выглядит как блестящий металл, сверкающий разными оттенками. В минералах халькоцит образует мелкозернистые или плотные включения.
- Куприт: этот минерал относится к группе оксидов и происходит из тех мест, где находится самородная медь или малахит.
- Ковеллит — такой минерал образуется только метасоматически. Содержит почти 67% меди. В Сербии, Италии и США есть крупные месторождения медной руды.
- Малахит, или как его еще называют поделочный камень, очень популярен, это медь зеленого цвета с двуокисью углерода. Если где-то обнаружен этот минерал, значит, рядом могут быть найдены и другие, содержащие в своем составе медь.

Технологии производства меди
Для извлечения меди из упомянутых выше минералов и полезных ископаемых в современной промышленности используются три технологии: гидрометаллургическая, пирометаллургическая и электролизная. Наиболее распространенный пирометаллургический метод обогащения меди использует в качестве сырья халькопирит. Эта технология предполагает выполнение нескольких последовательных операций. На первом этапе проводится обогащение медной руды, для чего используется окислительный обжиг или флотация.
Метод флотации основан на том, что пустая порода и ее части, содержащие медь, смачиваются по-разному. Когда всю массу породы помещают в ванну с жидким составом, в которой образуются пузырьки воздуха, та ее часть, которая содержит в своем составе минеральные элементы, этими пузырьками выносится на поверхность, прилипая к ним. В результате на поверхности ванны собирается концентрат — медный блистер, в котором этого металла содержится от 10 до 35%. Именно из такого порошкообразного концентрата получается дополнительная чистая медь.
Несколько иной вид имеет окислительный обжиг, с помощью которого обогащаются минералы меди, содержащие значительное количество серы. Эта технология предполагает нагрев руды до температуры 700-8000, в результате чего сульфиды окисляются, а содержание серы в медной руде уменьшается почти вдвое. После обжига обогащенный минерал плавится в отражательных печах или печах с колодцами при температуре 14 500 ° С, в результате чего получается штейн — сплав, состоящий из сульфидов меди и железа.

Следует улучшить свойства получаемого штейна, для этого его выдувают в горизонтальные конвертеры без дополнительной подачи топлива. В результате этой боковой продувки железо и сульфиды окисляются, оксид железа превращается в шлак, а сера — в SO2.
Черновая медь, получаемая благодаря этому процессу, содержит до 91% этого металла. Чтобы металл стал еще чище, необходимо провести рафинирование меди, для чего необходимо удалить с нее примеси. Это достигается за счет использования технологии огневого рафинирования и подкисленного раствора сульфата меди. Такое рафинирование меди называется электролитическим, оно позволяет получить металл чистотой 99,9%.
Существует также гидрометаллургический метод обогащения меди, который включает выщелачивание металла серной кислотой. В результате такого выщелачивания получается раствор, из которого затем выделяются медь и другие металлы, в том числе драгоценные. Эта технология используется для обогащения полезных ископаемых, которые характеризуются очень низким содержанием меди в своем составе.
Природные соединения с содержанием меди
Чистая медь, представленная ее самородками, встречается в природе в очень небольших количествах. В основном медь встречается в природе в виде различных соединений, наиболее распространенными из которых являются следующие.
- Борнит — минерал, получивший свое название в честь чешского ученого И. Борна. Это сульфидный минерал, химический состав которого характеризуется формулой — Cu5FeS4. У борнита есть и другие названия: колчедан пестрый, медно-пурпурный. В природе этот минерал встречается в двух полиморфных формах: тетрагонально-скаленоэдрической при низкой температуре (температура ниже 228 градусов) и кубо-гексаоктаэдре при высокой температуре (более 228 градусов). Этот минерал может быть разных видов и в зависимости от происхождения. Например, экзогенный борнит — это ранний вторичный сульфид, который очень нестабилен и легко разрушается атмосферными факторами. Второй тип, эндогенный борнит, характеризуется противоречивым химическим составом, который может содержать халькоцит, галенит, сфалерит, пирит и халькопирит. Теоретически минералы этого типа могут включать в свой состав от 25,5% серы, более 11,2% железа и более 63,3% меди, но на практике такое содержание этих элементов никогда не поддерживается.
- Халькопирит — минерал, химический состав которого характеризуется формулой CuFeS2. Халькопирит, имеющий гидротермальное происхождение, раньше назывался медным пиритом. Вместе со сфалеритом и галенитом он относится к категории полиметаллических минералов. Этот минерал, который помимо меди содержит железо и серу, образуется в результате метаморфических процессов и может присутствовать в двух типах медных минералов: контактных метасоматических (скарны) и горных метасоматических (грейзенс).
- Кальцит — сульфидный минерал, химический состав которого характеризуется формулой Cu2S. Этот минерал содержит значительное количество меди (79,8%) и серы (20,2%). Этот минерал часто называют «медным блеском», потому что его поверхность выглядит как блестящий металл с различными оттенками от свинцово-серого до полностью черного. В медьсодержащих минералах халькоцит проявляется в виде плотных или мелкозернистых включений.

Халькопирит
В природе встречаются и более редкие минералы, содержащие медь.
- Куприт (Cu2O), минерал группы оксидов, часто встречается в местах, где встречаются самородная медь и малахит.
- Ковеллит — это сульфидная порода, образовавшаяся метасоматически. Впервые этот минерал, содержание меди в котором составляет 66,5%, был обнаружен в начале 19 века в окрестностях Везувия. Сейчас ковеллит активно добывают на месторождениях таких стран, как США, Сербия, Италия, Чили.
- Малахит — это минерал, известный всем как поделочный камень. Наверняка каждый видел на фото изделия из этого прекрасного минерала или даже владеет ими. Малахит, который очень популярен в России, представляет собой углекислый медно-зеленый или дигидроксикарбонат меди, который относится к категории медьсодержащих полиметаллических минералов. Найденный малахит указывает на то, что поблизости есть месторождения других медьсодержащих минералов. В нашей стране крупное месторождение этого минерала находится в Нижнетагильской области, раньше его добывали на Урале, но сейчас его запасы значительно истощены и не разрабатываются.
- Азурит — это минерал, который также называют «голубой медью» из-за его синего цвета. Он характеризуется твердостью 3,5-4 единиц, его основные месторождения разрабатываются в Марокко, Намибии, Конго, Англии, Австралии, Франции и Греции. Азурит часто переплетается с малахитом и встречается в местах, где поблизости находятся месторождения минералов сульфида меди.

Малахит
КЛАССИФИКАЦИЯ
Здравствуйте, CIM Ref1.1
| Струнц (8-е издание) | 1 / A.01-10 |
| Никель-Струнц (10-е издание) | 1.ГГ.05 |
| Дана (7-е издание) | 1.1.1.3 |
| Дана (8-е издание) | 1.1.1.3 |
Альтернативный способ обогащения меди
Есть еще один хороший метод обогащения меди — это использование серной кислоты для выделения необходимого металла.

В результате получается раствор, из которого впоследствии извлекаются медные руды; золото можно получить таким же образом. Этот метод используется в тех случаях, когда присутствие меди в составе минерала не так уж и велико.
ФИЗИЧЕСКИЕ СВОЙСТВА
| Минеральный цвет | медно-красный, переходящий в черный или зеленый в воздухе |
| Цвет линии | медно-красный |
| Прозрачность | непрозрачный |
| Блеск | металл |
| Декольте | нет |
| Твердость (шкала Мооса) | 2,5-3 |
| Власть | податливый |
| Расставаться | зазубренный |
| Плотность (измеренная) | 8,94 — 8,95 г / см3 |
| Радиоактивность (GRApi) | 0 |
| Магнетизм | диамагнетик |
Из каких руд получают медь
Интересно! Медь очень редко встречается в природе в виде самородков. На сегодняшний день самой крупной находкой такого типа считается найденный в Северной Америке самородок весом 420 тонн.
Существует около 250 видов меди, но только 20 из них используются в промышленности. Наиболее распространены:
Халькозин
Сочетание минералов с серой (20%) и медью (80%). Его называют «медным блеском» из-за характерного металлического блеска. Минерал бывает плотным или зернистым, черного или серого цвета.
Халькопирит
Этот металл имеет гидротермальное происхождение и содержится в скарнах и грейзенах. Чаще всего он входит в состав полиметаллического минерала наряду с галенитом и сфалеритом.
Борнит
Минерал класса сульфидов, широко распространенный в природе, один из основных элементов медных руд. Имеет характерный голубовато-фиолетовый оттенок. Содержит примеси меди (63,33%), железа (11,12%), серы (25,55%) и серебра. Он имеет вид плотной мелкозернистой массы.
Медь. Химия меди и ее соединений
Положение в периодической таблице химических элементов
Медь находится в группе 11 (или вторичной подгруппе группы II в краткосрочной ПСЭЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии :
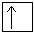
+ 29Cu 1s22s 2 2p 6 3s 2 3p 6 3d 10 4s 1
1 с
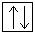
2 с

2p
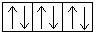
3 с

3p

4 с
3d
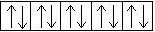
Для атома меди, уже находящегося в основном энергетическом состоянии, происходит провал (проскальзывание) электрона с подуровня 4s на подуровень 3d.
Физические свойства
Медь — твердый металл цвета розового золота (розовый цвет при отсутствии оксидной пленки). С медью сравнительно легко работать. Он встречается в природе даже в чистом виде и широко используется в различных областях науки, техники и производства.

Температура плавления около 1083,4 ° C, температура кипения около 2567 ° C, плотность меди 8,92 г / см 3 .
Медь — драгоценный металл в индустрии вторичной переработки. Сдав медный лом на пункт сбора, вы можете получить хорошее денежное вознаграждение. Подробнее о приеме медного лома.
Нахождение в природе
Медь содержится в земной коре (0,0047-0,0055 по весу), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородной форме. В промышленности используется халькопирит CuFeS2, также известный как медный пирит, халькоцит Cu2S и борнит Cu5FeS4. Обычны и другие минералы меди: ковеллит CuS, куприт Cu2O, азурит Cu3 (CO3) 2 (OH) 2, малахит Cu2 (OH) 2 CO 3. Иногда медь встречается в самородной форме, масса которой может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы производства меди — электролизный, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: растворение медных руд в разбавленных растворах серной кислоты с последующим вытеснением металлическим железом.
Например, замена меди из сульфата на железо:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод: получение меди из сульфидных минералов. Это сложный процесс, включающий большое количество реакций. Основные этапы процесса:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди оксидом, например водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 — взаимодействие солей меди (II) со щелочами. При этом образуется синий осадок гидроксида меди (II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически неактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например с кислородом, образуя CuO, Cu2O, в зависимости от условий:
2Cu + 2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
2Cu + I2 = 2CuI
1.4. Медь не реагирует с азотом, углеродом и кремнием:
Cu + N2
Cu + C
Cu + Да
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь также взаимодействует со сложными веществами:
2.1. В сухом воздухе и при комнатной температуре медь не окисляется, но во влажном воздухе в присутствии окиси углерода (IV) она покрывается зеленым налетом гидросомат карбоната (II):
2.2. В ряду напряжений медь находится справа от водорода и поэтому не может заменить водород растворами минеральной кислоты (разбавленной серной кислотой и т.д.).
Например, медь не реагирует с разбавленной серной кислотой :
2.3. В этом случае медь реагирует при нагревании с концентрированной серной кислотой. При нагревании протекает реакция, образуется оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь также реагирует в нормальных условиях с азотной кислотой .
2.5. Щелочные растворы практически не действуют на медь.
2.6. Медь вытесняет металлы, находящиеся прямо в ряду напряжений, из растворов их солей .
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg (NO 3) 2 + Cu = Cu (NO 3) 2 + Hg
2.7. Медь окисляется солями оксида азота (IV) и железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO представляет собой твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить разными способами :
1. Термическое разложение гидроксида меди (II) при 200 ° C :
2. В лабораторных условиях оксид меди (II) получают окислением меди при нагревании на воздухе до 400–500 ° С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) получают также прокаливанием солей (CuOH) 2CO3, Cu (NO3) 2:
Химические свойства оксида меди (II)
Оксид меди (II) — это основной оксид (при этом он имеет слабые амфотерные свойства). К тому же это довольно сильный окислитель.
1. Когда оксид меди (II) взаимодействует с сильными растворимыми кислотами, образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) реагирует с кислотными оксидами.
Например, оксид меди (II) реагирует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или оксидом углерода при нагревании:
UO + C → Cu + CO
Наиболее активные металлы заменяют медь оксидом.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O представляет собой красно-коричневое кристаллическое твердое вещество.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) имеет основные свойства.
Когда оксид меди (I) подвергается действию галогенводородных кислот, образуются галогениды меди (I) и вода:
Например, соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl + H2O
2. При растворении Cu2O в концентрированной серной и азотной кислотах образуются только соли меди (II):
3. Стабильные соединения меди (I) — это нерастворимые соединения (CuCl, Cu2S) или комплексные соединения Cu (NH3) 2 +. Последние получают растворением оксида меди (I) и хлорида меди (I) в концентрированном растворе аммиака):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2 Cu (NH3) 2 Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например, при взаимодействии с оксидом углерода, более активными металлами или водородом оксид меди (II) проявляет окислительные свойства :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например кислорода, свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием щелочного раствора на соли меди (II).
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu (OH) 2 + 2NaCl
Химические свойства
Гидроксид меди (II) Cu (OH) 2 обладает слабо выраженными амфотерными свойствами (с преобладанием основных).
1. Взаимодействует с кислотами .
Например, он взаимодействует с бромистоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя комплексное соединение сине-фиолетового цвета:
3. При взаимодействии гидроксида меди (II) с концентрированными щелочными растворами (более 40%) образуется комплексное соединение:
Но эта реакция на химический экзамен еще не доступна!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой :
Хлорид меди (I) также реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Другие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом на холоду и при нагревании образуются различные продукты окисления серы:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа Cu (NH3) 2 + получают растворением в концентрированном растворе аммиака :
Минеральная база для извлечения металла
Сырьем для добычи медной руды являются природные образования полезных ископаемых, в которых металлический компонент содержится в количестве, необходимом для экономически устойчивого промышленного развития.

Сырье для добычи медной руды.
Минеральные месторождения представлены силикатами, карбонатами, сульфатными соединениями, оксидами, образующимися в зоне окисления.
Среди полезных ископаемых, разведанных для промышленной разработки, есть:
- халькопирит;
- халькоцит;
- борнит;
- куприт;
- самородная медь;
- брошантит;
- азурит;
- кубанит;
- малахит;
- хризотил.
Концентрация металла в руде составляет 0,3-5%, а в минералах индекс концентрации составляет 22-100% (самородный металл). Месторождения меди генетически связаны с другими ценными компонентами, которые извлекаются как дополнительные химические элементы к основному процессу.
Среди связанных компонентов:
- платаны;
- серебряный;
- золото;
- теллур;
- галлий;
- молибден;
- висмут;
- никель;
- титан;
- цинк.
Минерал для добычи меди содержит мышьяк, сурьму, реже ртуть. В зависимости от типа сопутствующих химических элементов различают типы отложений, среди которых основными являются:
- медно-никелевый;
- медный пирит;
- песчаники и медистые сланцы;
- медный порфир.
Второстепенное значение имеют скарновые месторождения металлов и сульфидные образования кварца. В перспективе железомарганцевые конкреции, расположенные в донных отложениях Мирового океана, будут рассматриваться как сырье для промышленного производства металлов.
ОПТИЧЕСКИЕ СВОЙСТВА
| Цвет в отраженном свете | розово-белый |
| Плеохроизм | не плеохроа |
| Люминесценция в ультрафиолетовом излучении | нефлуоресцентный |
